غلظت در شیمی و زیستشناسی مقدار مولکولهای حلشونده در مقدار مشخصی از حلال را تعیین میکند. این کمیت را میتوان با روشهای مختلف ازجمله مولاریته، مولالیته، درصد وزنی، اسمولاریته و اسمولالیته گزارش کرد. اسمولاریته و اسمولالیته کمیتهای متداول برای اندازهگیری غلظت مایعات بدن موجودات زنده است که بر اساس انتقال آب بین دو محلولی که بهوسیله یک غشای نیمهتروا از هم جدا شده اند، تعریف میشود. غلظت آب و اسمولیتها در پروکاریوتها، آغازیان، گیاهان و جانوران با مکانیسمهای ویژهای تنظیم میشود. در نتیجه اختلاف غلظت نمکها و اسمولیتها بین سیتوپلاسم و محیط خارجی منجر به پاره شدن غشای پلاسمایی یا خارج شدن بیش از حد آب از سیتوپلاسم نمیشود. این کمیت در پلاسما غلظت ذرات حل شده در کل مایعات بدن را نشان میدهد. در آزمایشگاههای بالینی از اندازهگیری اسمولاریته برای تشخیص افتراقی اختلالهای کلیوی استفاده میشود. در این مطلب از مجله فرادرس توضیح میدهیم اسمولاریته چیست و با چه روشهایی میتوان آن را محاسبه کرد.
اسمولاریته چیست؟
اسمولاریته یکی از روشهای بیان غلظت در زیستشناسی و شیمی است. این کمیت غلظت مولکولها فعال اسمزی در هر لیتر محلول را اندازهگیری میکند و با واحدهای اسمول بر لیتر (Osml/L) یا میلیاسمول بر لیتر (mOsml) نمایش داده میشود. برای درک بهتر این کمیت ابتدا اسمز و فشار اسمزی را توضیح میدهیم. به عبور آب از یک غشای نیمه تراوا، از محیطی با غلظت آب بیشتر به محیط با غلظت آب کمتر اسمز گفته میشود. غشای نیمهتروا از منافذ بسیار کوچکی تشکیل شده است که نسبت به محلول نفوذپذیر و نسبت به حلشونده نفوذناپذیر است. به این مولکولهای حلشونده، مولکولهای فعال اسمزی گفته میشود. فشار اسمزی نیرویی است که سبب انتقال آب بین دو محلول جدا شده بهوسیله غشای نیمهتراوا میشود.
غشای پلاسمایی از دو لایه فسفولیپیدی تشکیل و پروتئینها تشکیل شده است. این غشا نسبت به مولکولهای کوچک غیرقطبی (مولکول اکسيژن، دیاکسید کربن و نیتروژن)، مولکولهای کوچک قطبی و بدون بار (آب، آمونیاک و گلیسرول) نفوذپذیر و نسبت به یونها و مولکولهای قطبی بدون بار نفوذناپذیر است. آب با اسمز بین سیتوپلاسم سلولها و مایعات بدن منتقل میشود. فشار اسمزی به دلیل اختلاف فشار غلظت محلول دو طرف غشای نیمهتراوا ایجاد میشود و برابر با نیروی لازم برای جریان آب است.
اسمولالیته چیست؟
اسمولالیته یکی دیگر از کمیتهای اندازهگیری تعداد ذرات در محلولها است. این کمیت تعداد ذرات حلشونده در هر کیلوگرم حلال را نشان میدهد.
تفاوت اسمولاریته و مولاریته
مولاریتی کمیتی است که تعداد مول حلشونده در حلال، اسمولاریته تعداد ذرات حلشونده در حلال را اندازهگیری میکند. بسیاری از ترکیبات پس از حلشدن در آب ذرات جدا از هم تبدیل میشوند. برای مثال سدیم کلرید در آب به یونهای سدیم و کلر جدا از هم تبدیل میشود. در نتیجه هر یک مول سدیم کلرید در آب برابر ۲ اسمول است.
محاسبه اسمولاریته
اسمولاریته محلولها را میتوان به کمک مولاریته و با استفاده از فرمول زیر محاسبه کرد. در این فرمول M مولاریته، n تعداد ذرات حلشونده و f ضریب اسمزی است. اسمولاریته محلولهایی که از چند حلشونده تشکیل میشوند، از جمع اسمولاریته تکتک حلشوندهها محاسبه میشود.
$$osmolarity= Mtimes ntimes f$$
ضریب اسمزی به غلظت حلشونده و ویژگیهای شیمیایی آن بستگی دارد. این مقدار در محلولها کمتر از یک است و با کاهش غلظت محلول افزایش مییابد. این کمیت را با استفاده از فشار اسمزی، نقطه انجماد، نقطه جوش و فشار بخار حلال محاسبه میکنند. برای مثال محلول ۰٫۳٪ سدیمکلرید را در نظر بگیرید. برای محاسبه اسمولایته این محلول ابتدا درصد وزنی را به مولاریته تبدیل میکنیم. در هر لیتر این محلول ۳۰ گرم سدیمکلرید حل شده است. وزن مولکولی هر مول سدیمکلرید ۵۸٫۴۴ گرم (Na+Cl = ۲۲٫۹۹+ ۳۵٫۴۵ ) است. در نتیجه مولاریته این محلول را میتوان با روش زیر محاسبه کرد.
$$30 frac{gr}{L}times frac{1 mol}{58.44 gr} = 0.51 M$$
هر مول NaCl در آب به دو ذره Na و Cl تبدیل میشود و ضریب اسمزی این نمک ۰٫۹۳ است. اسمولاریته این محلول را میتوان با استفاده از فرمول بالا محاسبه کرد.
$$osmolarity=0.51times 2 times 0.93 = 0.94 frac{Osm}{L}$$
محاسبه اسمولاریته پلاسما
بسیاری از فعالیتهای سلول، انتقال مواد از عرض غشای سیتوپلاسمی و پایداری شکل سلولها به اسمولاریته مایعات بدن بستگی دارد. اندازهگیری این کمیت در پلاسما به تعیین کاهش آب بدن (دهیدراتاسیون) یا افزایش اسمولیتها کمک میکند. سدیم، پتاسیم، کلر، بیکربنات، گلوکز و اوره ترکیبات تعیینکننده اسمولاریته پلاسما هستند. در نتیجه این کمیت در پلاسما را میتوان از جمع اسمولاریته این ترکیبات و فرمول بالا محاسبه کرد. غلظت کاتیونها و آنیونهای مایعات بدن با هم برابر است. به همین دلیل میتوان اسمولاریته یکی از این یونها را محاسبه و دو برابر کرد.
برای مثال، فرض کنید غلظت سدیم در نمونه یک بیمار ۱۴۰ $$frac{mEq}{L}$$ گزارش شده است. از آنجا که یون سدیم تکظرفیتی است مول و اکیوالان آن برابر و مولاریته آن ۱۴۰ میلیمول بر لیتر است. به علاوه سدیم در پلاسما به ذرات دیگری تقسیم نمیشود، و اسمولاریته و مولاریته آن با هم برابر است. در نتیجه اسمولاریته آنیونها و کاتیونهای این نمونه ۲۸۰ $$frac{mOsml}{L}$$ است.

غلظت گلوکز در این نمونه ۹۰ میلیگرم بر دسیلیتر گزارش شده است. گلوکز از ۶ اتم کربن (۶×۱۲)، ۱۲ اتم هیدروژن (۱۲×۱) و ۶ اتم اکسيژن (۶×۱۶) تشکیل شده و هر میلیمول این ترکیب برابر با ۱۸۰ میلیگرم است. با در نظر داشتن اینکه هر دسیلیتر، ۱۰ لیتر است، مولاریته گلوکز را میتوان با روش زیر محاسبه گرد.
$$90frac{mg}{dL}times frac{1 mmol}{180 mg} times frac{1 dL}{1 L } = 5 frac{mmol}{L}$$
اوره مولکول کوچکی با ۱ اتم کربن، ۱ اتم اکسیژن، ۴ اتم هیدروژن و ۲ اتم نیتروژن تشکیل شده است. غلظت اوره در پلاسما بر اساس نیتروژنها (Blood Urea Nitrogen | BUN) گزارش میشود. BUN این نمونه ۱۴ میلیگرم بر دسیلیتر گزارش شده است. در هر میلیمول اوره ۲۷ میلیگرم نیتروژن وجود دارد و مولاریته این ترکیب را میتوان با روش زیر محاسبه کرد.
$$14frac{mg}{dL}times frac{1 mmol}{28 mg} times frac{1 dL}{1 L } = 5 frac{mmol}{L}$$
اوره و گلوکز در پلاسما به ذرات دیگری تقسیم نمیشود. در نتیجه اسمولاریته و مولاریته آن با هم برابر است. اسمولاریته پلاسما در این مثال ۲۹۰ $$frac{mOsml}{L}$$ است. با توجه به محاسبات بالا، اسمولاریته گلوکز پلاسما را میتوان با تقسیم غلظت آن بر حسب میلیگرم بر دسیلیتر به عدد ثابت ۱۸ و اسمولایته BUN را میتوان با تقسیم غلظت اوره بر حسب میلیگرم بر دسیلیتر بر عدد ثابت ۲٫۸ محاسبه کرد. بر اساس محاسبات این مثال و فرمول کلی محاسبه اسمولاریته، غلظت پلاسما را میتوان از فرمول زیر تعیین کرد.
$$Osmolarity = (Natimes 2) + frac{Glu}{18} + frac{BUN}{2.8}$$
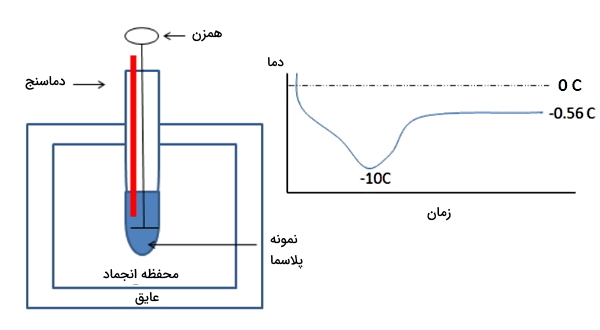
اندازه گیری اسمولاریته پلاسما با اسمومتر کاهش نقطه انجماد
اسمولاریته پلاسما را میتوان با اسمومتر کاهش نقطه انجماد اندازهگیری کرد. در این روش نمونه پلاسما در محفظه خنککننده با دمای پایینتر از نقطه انجماد پلاسما قرار میگیرد. در این شرایط همزدن پیوسته نمونه سبب تشکیل بلور در نمونه میشود. گرمای آزاد شده در این فرایند دمای نمونه را تا نقطه انجماد افزایش میدهد. منحنی استاندار انجماد در این مراحل رسم و اسمولاریته از فرمول زیر محاسبه میشود. در این فرمول $$triangle T$$ تغییر دما و $$k_f$$ ثابت انجماد (۱٫۸۶ $$frac{Kkg}{mol}$$) است.
$$triangle T= k_f times Osmolarity$$
تفاوت اسمولاریته پلاسما و مدفوع
اسمولاریته مدفوع معمولا با این کمیت در پلاسما برابر، اما اسمولیتهای آن متفاوت است. اسمولاریته مدفوع از جمع اسمولاریته یون سدیم و پتاسیم محاسبه میشود.
$$Osmolarity = 2times (Na+ k)$$
تفاوت مقدار اسمولاریته پلاسما و مدفوع به تشخیص دلیل بیماری اسهال کمک میکند. اگر اختلاف این کمیت به کمتر از ۵۰ $$frac{mOsml}{L}$$ برسد، منجر به اسهال ترشحی میشود. در این حالت افزایش نفوذپذیری غشای سلولهای دیواره روده به دلیل توکسین باکتریها با از دست دادن الکترولیتها همراه است. اگر اختلاف این کمیت به بیشتر از ۱۰۰ $$frac{mOsml}{L}$$ برسد، منجر به اسهال اسمزی میشود. در این حالت نفوذپذیری غشای سلولهای دیواره کاهش یافته و الکترولیتهای کیموس را جذب نمیکند.
تنظیم اسمولاریته در بدن موجودات
بسیاری از موجودات تکسلولی و پرسلولی ساده مواد غذایی مورد نیاز خود را بهوسیله اسمز از محیط اطراف دریافت میکنند. آب و مواد معدنی در ریشه گیاهان بهوسیله اسمز جذب میشود. ترشح هورمونها، انتقال جریان عصبی، انتقال مواد و بسیاری از فعالیتهای دیگر پستانداران به تفاوت اسمولاریته سلول و مایعات بدن بستگی دارد. افزایش غلظت سیتوپلاسم با ورود آب به سلول همراه است. اگر ورود آب به سلول کنترل نشود، افزایش حجم سلول منجر به پاره شدن غشای پلاسمایی و لیز شدن سلولها خواهد شد. کاهش اسمولاریته سیتوپلاسم با خروج آب از سلول همراه است. اگر خروج آب از سلول کنترل نشود کاهش حجم و از دست رفتن عملکرد سلول میشود. به همین دلیل موجودات زنده از مکانیسمهای مختلفی برای تنظیم دقیق اسمولاریته سلولها استفاده میکنند.
در بعضی از موجودات ازجمله آبزیان آب شور، اسمولاریته مایعات بدن همیشه با اسمولاریته محیط برابر است. مکانیسمهای تنظیمی این موجودات، اسمولاریته بدن را با افزایش یا کاهش غلظت محیط تغییر میدهند. در بعضی از موجودات ازجمله ماهیهای آب شیرین و پستانداران، اسمولاریته مایعات بدن با مکانیسمهای مستقل از غلظت محیط تنظیم میشود.
تنظیم اسمولاریته در پروکاریوت ها
تنظیم یونها و اسمولیتهای آلی دو مکانیسم تنظیم اسمولاریته در باکتریها است. هالوباکترها، باکتریهایی هستند که در محیطهایی با غلظت نمک (اسمولاریته) بالا رشد میکنند. در این باکتریها اسمولاریته یونهای سیتوپلاسم با اسمولاریته محیط اطراف برابر است. تعداد آمینواسیدهایی با آبگریزی پایین و اسیدی در پروتئینهای این باکتریها افزایش یافته است. برهمکنش بین بار الکتیکی آمینواسیدها و الکترولیتهای سیتوپلاسم پایداری ساختار پروتئینها را افزایش میدهد.
اولین پاسخ باکتریهای گرم مثبت و گرم منفی به افزایش اسمولایته محیط، جذب پتاسیم (کاتیون) و افزایش سنتز گلوتامات (آنیون) در سلول است. پتاسیم بهوسیله پمپهای غشایی و با مصرف ATP وارد سلول میشود. در مرحله دوم افزایش غلظت پتاسیم-گلوتامات منجر به تجمع اسمولیتهای بدون بار در سیتوپلاسم میشود. این اسمولیتها برخلاف یونها فعالیتهای سلولی را مختل نمیکند. بتائین گلایسن، کارنیتین و پرولین سه اسمولیت مهمی هستند که در تنظیم اسمولاریته باکتریها نقش دارند. بتائین گلایسن با دو مرحله واکنشهای آنزیمی اکسایش-کاهش از کولین سنتز میشود. بیشتر باکتریها کارنیتین را از محیط اطراف دریافت میکنند. پرولین در بیشتر باکتریها در سه مرحله واکنش آنزیمی از گلوتامات سنتز میشود.
در باکتریهای گرم منفی افزایش اسمولاریته محیط بیان ژنهای پورینهای غشای خارجی را تغییر میدهد. در این شرایط بیان ژن ompF کاهش و بیان ژن ompC افزایش مییابد. این کانالهای پروتئینی به انتقال آب و مولکولهای هیدروفیل کوچک به سلول کمک میکند. در شرایطی که اسمولاریته محیط از اسمولاریته سیتوپلاسم باکتریها کمتر است، فعال شدن کانالهای حساس به کشش با خروج جریان یونی از سلول همراه میشود. به علاوه افزایش تعداد آکوآپورینهای غشا به افزایش انتقال آب کمک میکند.
تنظیم اسمولاریته در تک سلولی ها
واکوئلهای انقباضی اندامکهای غشادار تنظیم اسمولاریته در آغازیان و جلبکهای تکسلولیها هستند. زیستگاه بیشتر این موجودات آبهای شیرین و اسمولاریته سیتوپلاسم سلول از محیط اطراف کمتر است. در نتیجه آب پیوسته همراه مواد غذایی وارد سیتوپلاسم میشود. آب اضافی و باقیمانده موادغذایی به واکوئولها منتقل و با انقباض واکوئل در فواصل منظم از سلول خارج میشود.






























































تنظیم اسمولاریته در ماهی ها
کلیه و آبشش دو اندام اصلی تنظیم اسمولاریته مایعات بدن ماهیها هستند. اما ساختار و مکانیسم عمل آنها در انواع ماهیها کمی متفاوت است. زیستگاه بیشتر ماهیهای استخوانی در آبهای شیرین است. اسمولاریته آب شیرین از اسمولاریته بدن ماهیها کمتر است. در نتیجه آب پیوسته از پوست و آبششها وارد بدن این موجودات شده و الکترولیتها خارج میشود. در کلیه ماهیهای آب شیرین گلومرولهای بزرگی وجود دارد که به ترشح حجم زیادی از آب در لولههای نفرونی کمک میکند. بیشتر الکترولیتها ترشح شده در لولههای نفرونی در لوله پیچخورده نزدیک، لوله پیچخورده دور و قوس هنله بازجذب میشود. در نتیجه حجم ادارار در این ماهیها زیاد و غلظت آن بسیار کم است. در این ماهیها حجم کمی از آب از را دهان وارد بدن میشود. بهعلاوه سلولهای کلرید در غشای آبششها با استفاده از پمپهای یونی، الکترولیتها را بر خلاف شیب غلظت، از آب به بدن منتقل میکنند.
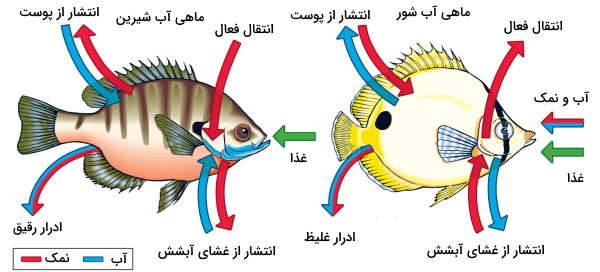







اسمولاریته مایعات بدن ماهیهای استخوانی آب شور از اسمولاریته محیط کمتر است. به همین دلیل آب پیوسته از پوست و آبششها از بدن خارج شده و الکترولیتها وارد بدن میشود. در این ماهیها گلومرولهای کلیه کوچک است و یونها در لولههای نفرونی بازجذب نمیشود. در نتیجه حجم ادرار این موجودات کم و غلظت آن زیاد است. ماهیهای استخوانی آب شور برای جبران آب از دستداده، حجم زیادی از آب را از راه دهان به بدن منتقل میکنند. به علاوه پمپ یونی سلولهای کلرید غشای آبشش این ماهیها، الکترولیتها را بر خلاف شیب غلظت از بدن به آب منتقل میکنند.
در ماهیهای غضروفی آب شور اسمولاریته مایعات بدن با اسمولاریته آب اطراف برابر است. در این موجودات تمام سلولهای به جز سلولهای مغز اوره تولید میکند. تقریبا تمام اوره در لولههای نفرونی بازجذب میشود و اسمولاریته بدن را افزایش میدهد. این اسمولیت ساختار آنزیمها را ناپایدار و عملکرد آن را تغییر میدهد. به همین دلیل سلولها با تولید تریمتیل آمین اکسید اثر اوره را خنثی میکنند. حجم ادرار این موجودات کم و غلظت نمک آن زیاد است. به علاوه آب از راه دهان وارد بدن این ماهیها نمیشود.
تنظیم اسمولاریته در گیاهان
در گیاهان روزنهها بهوسیله فرایند تبخیر-تعریق غلظت آب در کل بافتهای گیاه و واکوئلها غلظت آب در هر سلول را کنترل میکنند. باد شدید، کاهش رطوبت و افزایش دما از دست رفتن آب بهوسیله تعریق و تبخیر را افزایش میدهند. در نتیجه اسمولاریته سیتوپلاسم سلولهای گیاهی افزایش مییابد. ترشح هورمون آبسیزیک اسید در این شرایط بسته شدن روزنهها را تحریک کرده و از خروج آب بیشتر جلوگیری میکند. گیاهان در زیستگاههای متفاوتی رشد و از مکانیسمهای متفاوتی برای سازگاری با محیط و تنظیم اسمولاریته استفاده میکنند. بر این اساس گیاهان را به انواع گزروفیت، هیدروفیت، هالوفیت و مزوفیت تقسیم میکنند.
- گزروفیتها: زیستگاه این گیاهان مناطق خشک و بیابانی است. در سیتوپلاسم سلولهای این گیاهان تعداد زیادی واکوئل بزرگی برای ذخیره آب وجود دارد. تغییر شکل برگها، روزنههای کوچک و لایه ضخیم کوتیکول تبخیر آب در این گیاهان را کاهش میدهد.
- هیدروفیتها: این گیاهان در سطح، نزدیک سطح یا عمیق زیستگاههای آبی رشد میکنند. ریشه در این گیاهان وجود ندارد یا اندازه آن کاهش یافته است. در بیشتر این گیاهان آب، موادغذایی و CO2 از تمام سطح گیاه جذب میشود. روزنه در این گیاهان وجود ندارد. لایه کوتیکولی سطح برگهای پهن در هیدروفیتها از تبخیر آب جلوگیری میکند.
- هالوفیتها: هالوفیتها در زیستگاههای آبی و خشکی با غلظت نمک زیاد رشد میکنند. کوتیکول ضخیم سطح اپیدرم و روزنه کوچک این گیاهان از تبخیر آب جلوگیری میکند. غدد نمک، الکترولیتهای اضافی را از گیاه خارج میکنند. به علاوه تقسیم یونها بین سیتوزول، واکوئل و آپوپلاست، به تنظیم اسمولاریته کمک میکند.
- مزوفیتها: زیستگاه مزوفیتها خاکهای حاصلخیز است. این گیاهان آب از دستداده بهوسیله تعریق و تبخیر را با جذب آب در ریشه جبران میکنند.
تنظیم اسمولاریته در انسان
ثابت بودن غلظت الکترولیتها آب مایع میانبافتی و سیتوپلاسم فاکتوری حیاتی برای عملکرد صحیح سلولها است. تحریک یا مهار ترشح هورمونها، انتقال جریان عصبی، انتقال مواد در عرض غشای پلاسمایی و بسیاری از فعالیتها بدن انسان به تنظیم اسمولاریته مایعات بدن دارد. حجم کلی آب بدن بهوسیله مکانیسمهای ایجاد احساس تشنگی و دفع آب از کلیهها تنظیم میشود. کلیه با تغییر غلظت یا حجم ادرار در پاسخ به هورمونها، در تنظیم اسمولاریته بدن نقش دارد.
گیرندههای اسمزی هیپوتالاموس، سلولهای عصبی ناحیه جلویی این غده هستند که با افزایش اسمولاریته مایعات بدن تحریک میشوند. تحریک این گیرندهها با ارسال پیام عصبی به مرکز کنترل احساس تشنگی و لوب خلفی هیپوفیز همراه است. تحریک هیپوفیز، ترشح هورمون ضدادراری از این غده را تحریک میکند. این هورمون به گیرندههای سطح قاعدهای سلولهای دیواره لوله پیچخورده دور و جمعکننده ادرار متصل میشود. اتصال هورمون-گیرنده در این سلولها سبب افزایش تعداد کانالهای آب (آکوآپورین) در غشای لومنی این سلولها میشود. در نتیجه بازجذب آب از ادرار افزایش و حجم ادرار کاهش مییابد. در نتیجه اسمولاریته پلاسما کاهش و اسمولاریته ادرار افزایش مییابد.
آلدوسترون و آنژیوتانسین دو هورمونی هستند که با افزایش بازجذب سدیم به افزایش اسمولاریته مایعات بدن انسان کمک میکنند. در این سیستم تنظیمی تغییر حجم، کاهش فشار، غظت پتاسیم و سدیم خون، ترشح آنزیم رنین از سلولهای جاگساگلومرولی کلیه را تحریک میکند. این آنزیم پروتئین آنژیوتانسینوژن موجود در پلاسما را به آنژیوتانسین I تبدیل میکند. آنژیوتانسین I بهوسیله آنزیم کانورتاز در سلولهای ریه به آنژیوتانسین IIتبدیل میشود. اتصال آنژیوتانسین II به گیرنده سلولهای زونا گلومروسا در غدد فوق کلیه سنتز و ترشح آلدوسترون را تحریک میکند. آلدوسترون بازجذب سدیم از لوله پیچخورده دور و لوله جمعکننده ادرار را افزایش میدهد. افزایش بازجذب سدیم با افزایش آب از نفرونها همراه است.
سوالات متدوال
در این بخش از مطلب مجله فرادرس به تعدادی از سوالات متدوال پیرامون اسمولاریته پاسخ میدهیم.
اسمولاریته طبیعی ادرار و خون چقدر است؟
اسمولاریته طبیعی ادرار با اسمولاریته خون برابر و بین ۲۵۰ تا ۳۰۰ میلیاسمول بر لیتر است.
اسمولیت چیست؟
اسمولیتها ترکیبات آلی با وزن مولکولی پایینی هستند که نقش مهمی در تنظیم اسمولاریته مایعات بدن موجودات مختلف در تغییرات شدید اسمولاریته محیطی دارند. بتائین و مشتقات آن، کربوهیدراتها و پلیاُلها و آمینواسیدها، اسمولیتهای اصلی سلولها هستند.
source